間葉系幹細胞由来培養上清のドライアイに対する効果を確認【ロート製薬】
ロート製薬株式会社が、大阪大学大学院医学系研究科の林竜平寄附講座教授(幹細胞応用医学)、西田幸二教授(眼科学、先導的学際研究機構(OTRI)生命医科学融合フロンティア研究部門)との共同研究により、脂肪組織由来間葉系幹細胞の培養上清(AdMSC-CM)の点眼がドライアイモデルに対して角膜のバリア機能を改善し、角膜上皮細胞の障害を抑制することを明らかにした。今回の成果により、これまで十分に治療法が確立されていない重症ドライアイ等の疾患に対して、AdMSC-CMが治療薬となる可能性が期待される。本研究成果は、英国科学誌「Scientific Reports」に、8月11日に掲載された。
研究成果のポイント
・脂肪組織由来間葉系幹細胞の培養上清(AdMSC-CM)は角膜上皮細胞の細胞死や炎症性物質の発現を抑え、バリア機能を向上した
・AdMSC-CMによる効果は、TGF-β※1やJAK-STATシグナル※2が関与することを明らかにした
・AdMSC-CMの点眼は、ドライアイモデルに対して角膜のバリア機能を改善し、角膜上皮障害を抑制した
・AdMSC-CMがドライアイの新しい治療薬となる可能性が示唆された
研究の背景
当社は1904年の目薬発売からアイケアに取り組み、2013年からは再生医療事業、2020年からは医療用眼科領域に参入してきました。これまでに当社は大阪大学とiPS細胞や間葉系幹細胞といった幹細胞を用いた眼に対する再生医療の研究に取り組んでおり、今回は間葉系幹細胞の培養上清のドライアイ治療薬への応用を目指し取り組んだ研究です。
ドライアイは様々な要因により発症し、涙液の減少や質の低下に伴う角膜上皮障害を起こします。さらに、シェーグレンシンドローム※3等の重症ドライアイでは、角膜の炎症やバリア機能の低下が見られますが、現在根本的な治療法が存在しません。
脂肪由来間葉系幹細胞は、脂肪組織にある幹細胞であり、多くの生理作用を持つことから細胞製剤として臨床応用が進んでいます。また、脂肪由来間葉系幹細胞からの分泌物を含む培養上清(AdMSC-CM)に関しても、多くの作用を持つことが報告されており、新しい創薬ツールとしての開発が期待されています。一方、AdMSC-CMの効果や作用機序に関しては研究が不十分であり、不明な点が多くあります。
今回の研究では、AdMSC-CMのドライアイに対する創薬開発を目指し、角膜上皮細胞やドライアイモデルに対する効果や作用機序の解明を行いました。
結果
(1)AdMSC-CMが角膜上皮細胞の細胞死や炎症性物質の発現を抑制し、バリア機能を向上した
脂肪組織由来の間葉系幹細胞の培養後の培地(AdMSC-CM)を回収し、塩化ベンザルコニウム(BAC)誘導型角膜上皮障害モデルに添加し培養したところ、角膜上皮細胞の細胞死を抑制しました(図1A)。また、AdMSC-CMはBACによる炎症性物質(IL6, TNF)の遺伝子発現の上昇を抑制しました(図1B)。
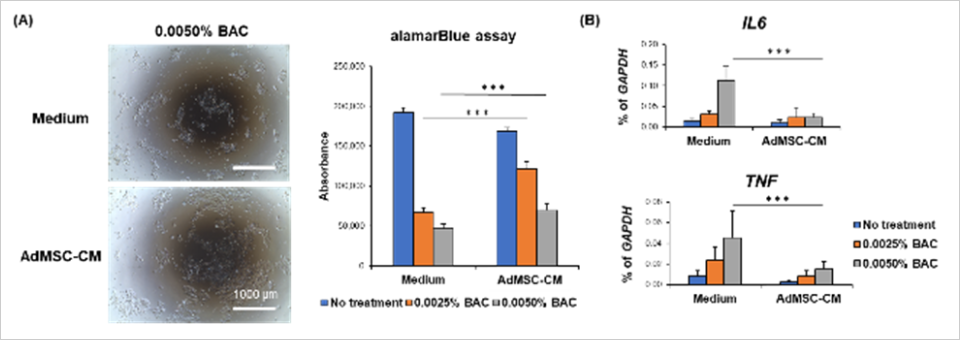
〈試験方法〉
脂肪組織由来間葉系幹細胞を80%コンフルエントまで培養した後、培養上清回収用の培地に交換し、72時間培養後の培養上清(AdMSC-CM)を回収した。BAC誘導型角膜上皮障害モデルにAdMSC-CM を添加して培養したのち、角膜上皮細胞の細胞生存率を目視による観察やalamarBlue assayにより評価した。また、炎症性物質であるIL-6,TNFの遺伝子発現をqRT-PCRにより解析した。(大阪大学大学院医学系研究科実施)
続いて、BACによる角膜上皮細胞のバリア機能障害に対するAdMSC-CMの効果を確認したところ、バリア機能の指標となるTER※4の低下をAdMSC-CMが改善しました(図2A)。さらに、バリア機能関連タンパク質(TJP1, MUC16)発現の低下をAdMSC-CMが改善しました(図2B)。
以上の結果より、AdMSC-CMが角膜上皮細胞の細胞死の抑制、炎症性物質の発現抑制、バリア機能の亢進効果を有することが明らかになりました。
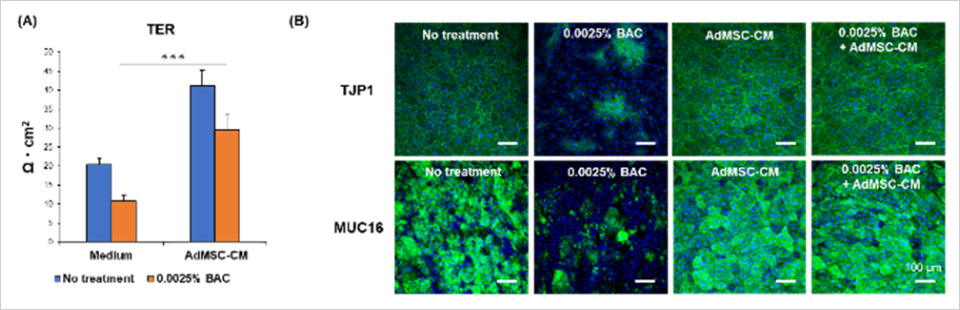
〈試験方法〉
セルカルチャーインサート上に角膜上皮細胞を播種したBAC誘導型角膜上皮障害モデルにおいて、AdMSC-CMを添加して培養したのち、角膜上皮細胞のバリア機能の指標であるTERを測定した。また、免疫染色でバリア機能関連タンパク質の発現を解析した。(大阪大学大学院医学系研究科実施)
(2)AdMSC-CMの作用機序としてTGF-βやJAK-STATシグナルが関与することを確認した
作用機序を解明するために、RNA-seq解析や薬理学的阻害剤を用いた検討を行いました。その結果、TGF-β※1やJAK-STATシグナル※2に関連する遺伝子の発現をAdMSC-CMが抑制していること、さらに両シグナルの阻害剤を用いると、BAC誘導型角膜上皮障害モデルにおいてAdMSC-CMと同様の効果が得られることが明らかになり、AdMSC-CMの作用機序としてTGF-βやJAK-STATシグナルが関与することを発見しました(図3)。
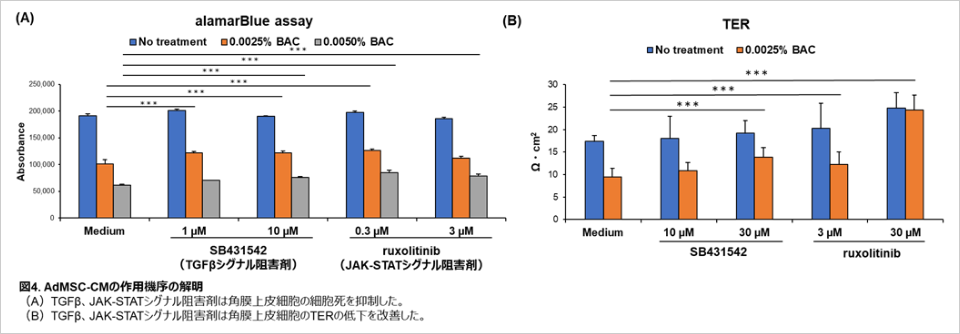
〈試験方法〉
BAC誘導型角膜上皮障害モデルにおいて、TGF-βシグナル阻害剤(SB431542)もしくはJAK-STATシグナル阻害剤(ruxolitinib)を添加して培養したのち、角膜上皮細胞の細胞生存率をalamarBlue assayにより解析し、バリア機能を評価するためTERを測定した。(大阪大学大学院医学系研究科実施)
(3)AdMSC-CMはドライアイモデルの角膜上皮バリアに関連するタンパク質発現の低下を改善し、角膜上皮障害を抑制した
ドライアイに対するAdMSC-CMの効果を検討するため、涙液量の低下に伴い角膜上皮障害を発症するドライアイモデルに対し、AdMSC-CMの点眼による効果を評価しました。その結果、AdMSC-CMはドライアイモデルの、角膜上皮バリアに関連するタンパク質発現の低下を改善し、角膜上皮障害を抑制することが明らかになりました(図4)。以上の結果より、ドライアイに対するAdMSC-CMの効果や作用機序を明らかにしました。
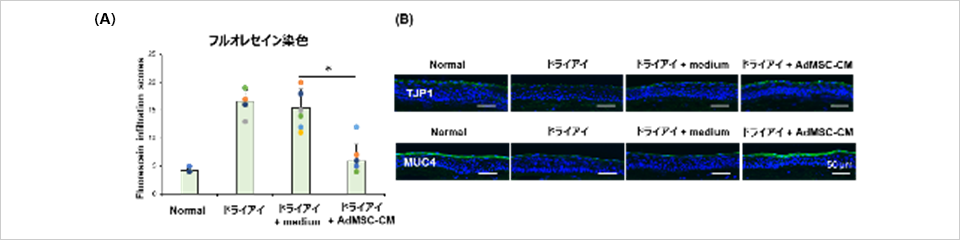
〈試験方法〉
ドライアイモデルに1日3回AdMSC-CMを点眼し、一週間後に角膜上皮障害をフルオレセイン染色にて評価し、バリア機能関連タンパク質の発現を蛍光染色により解析した。(大阪大学大学院医学系研究科実施)
今後の展望
本研究成果により、AdMSC-CMが複数の薬理作用を通してドライアイ等の角膜疾患の新規治療薬として確立できる可能性が示されました。今後、AdMSC-CMの有効成分の探索やさらに詳細な作用機序の解明を行うことで、ドライアイ治療薬としての開発を進めるだけでなく、他の疾患に対する応用や新たな創薬標的の発見、間葉系幹細胞による効果の作用機序解明に繋がることが期待されます。
用語説明
※1:TGF-βシグナル
Transforming growth factor -β(TGF-β)シグナルは、細胞の増殖や分化、細胞死、線維化等を制御する多彩な機能をもつ調節因子。
※2:JAK-STATシグナル
Janus kinase-signal transducer and ctivator of transcription(JAK-STAT)シグナルは、細胞の増殖や分化、炎症等に関わる様々なサイトカインのシグナル伝達系。
※3:シェーグレンシンドローム
涙腺、唾液腺等の外分泌腺に慢性的に炎症が発症する自己免疫疾患。涙液分泌が著しく減少することで重度の角膜上皮障害や角膜のバリア機能の低下が認められる。
※4:TER
経上皮電気抵抗値(Transepithelial electrical resistance;TER)は、角膜や皮膚などにおいてバリア機能を評価する際に用いられる代表的な指標。

































