SENTAN Pharma、網膜色素変性症を対象にしたピタバスタチンナノ粒子製剤を開発、第1相医師主導治験を2026年度開始へ
株式会社SENTAN Pharma (福岡県福岡市、松原 正東 代表取締役) は、同社と九州大学医学部眼科 (村上祐介准教授) が共同で開発を進めているピタバスタチンのナノ粒子静脈内投与製剤について、医薬品医療機器総合機構 (PMDA) の対面助言を終了し、治験薬GMP製造を開始、2026年度に網膜色素変性症患者を対象とした第1相医師主導治験を開始する予定であることを発表した。
ピタバスタチンナノ粒子製剤の開発背景
ピタバスタチン (pitavastatin) は 、HMG-CoA 還元酵素阻害作用によりコレステロールの生合成を抑制するスタチン系薬剤であり、もともとは高コレステロール血症の治療薬として開発された。加えて抗炎症作用や血管新生促進作用など、多面的な薬理効果を有することも知られている。
同社では、このピタバスタチンをナノ粒子化することにより、薬剤が血管内皮細胞に選択的に送達され、血管新生が誘導される可能性に着目しました。これにより、肺細動脈病変の進行を抑制できることが示唆されたことから、ナノ粒子注射製剤としての開発を推進し、重症肺高血圧症を対象とした医師主導治験 (Phase1 試験)、また、重症虚血肢を対象とした医師主導治験 (Phase1/2a 試験) も完了している。
しかしながら、当時のナノ粒子製造技術では製造コストが非常に高く、安定した大量製造も困難であったため、製品化には至っていなかった。その後、同社はナノ粒子の安定かつ大量製造が可能な技術を確立し、生産コストの大幅な削減に成功した。現在は、難水溶性であるピタバスタチンをナノ粒子化し、注射用水への分散・可溶化を実現した静脈内注射製剤として再開発を進めており、従来困難であった大量製造が可能となったことで、臨床応用に向けた新たな展開が期待されている。
開発成果
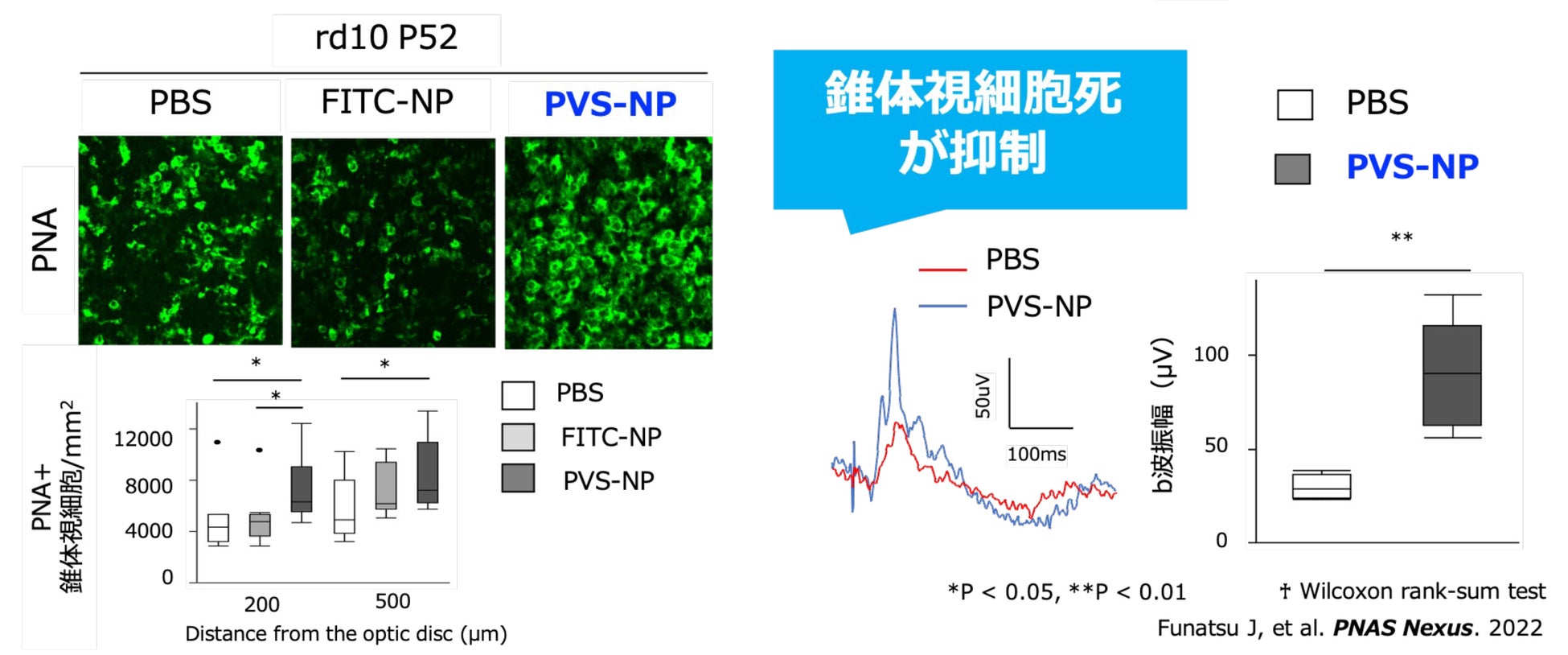
網膜色素変性症 (Retinitis Pigmentosa:RP) は、治療法が確立されていない遺伝性の難治性疾患であり、失明原因の第二位を占めている。初期には暗視野に関与する桿体視細胞が障害され、夜盲や視野狭窄が現れる。進行に伴い中心視力や色覚に関与する錐体視細胞死が起こり、最終的には失明に至る。RP の病因には約 100種類の原因遺伝子が報告されており、遺伝背景は多様だが、最終的には網膜の錐体視細胞が傷害され、網膜変性を来たすという病態は共通している。
九州大学医学部・村上佑介准教授らの研究により、末梢血中の炎症性単球がマクロファージに分化し、網膜変性を促進することが明らかになった。この知見に基づき、RP に対して炎症制御を軸に据えた、病因に依存しない新たな治療戦略に着目した共同開発を推進している。RP モデルマウスを用いた有効性試験では、ピタバスタチンナノ粒子静脈内投与製剤により、4週に1度の投与頻度においても錐体視細胞死が有意に抑制された結果が得られており(Funatsu et al., 2022)、RP 病態の進行抑制が期待されている。
旧製剤では、健常者を対象としたピタバスタチンナノ粒子製剤を用いた安全性試験の結果として薬剤は速やかに消失し、反復投与による蓄積性もないことが示された。再開発したピタバスタチンナノ粒子新製剤は大量製造を可能とする製造方法のみを改良し、旧製剤との同等性が医薬品医療機器総合機構 (PMDA) より認められたため、旧製剤にて実施した非臨床試験および臨床治験データを一部利用し、開発期間・コストを大幅に短縮・削減しながら開発を推進している。さらに、非臨床安全性試験の充足性についても PMDA の合意を得られたため、RP 患者を対象とした医師主導治験に向けた準備を進めている。
今後の予定
同社が開発を進めているピタバスタチンのナノ粒子静脈内投与製剤について、医薬品医療機器総合機構(PMDA)の対面助言を終了し、治験薬GMP製造を開始、2026年度に網膜色素変性症患者を対象とした第1相医師主導治験を開始する予定だ。ピタバスタチンの抗炎症作用を活かし、末梢血炎症性単球の活性化及び神経炎症の抑制を通じて、網膜感度低下の進行抑制と患者さまの QOL 維持を目指している。




































